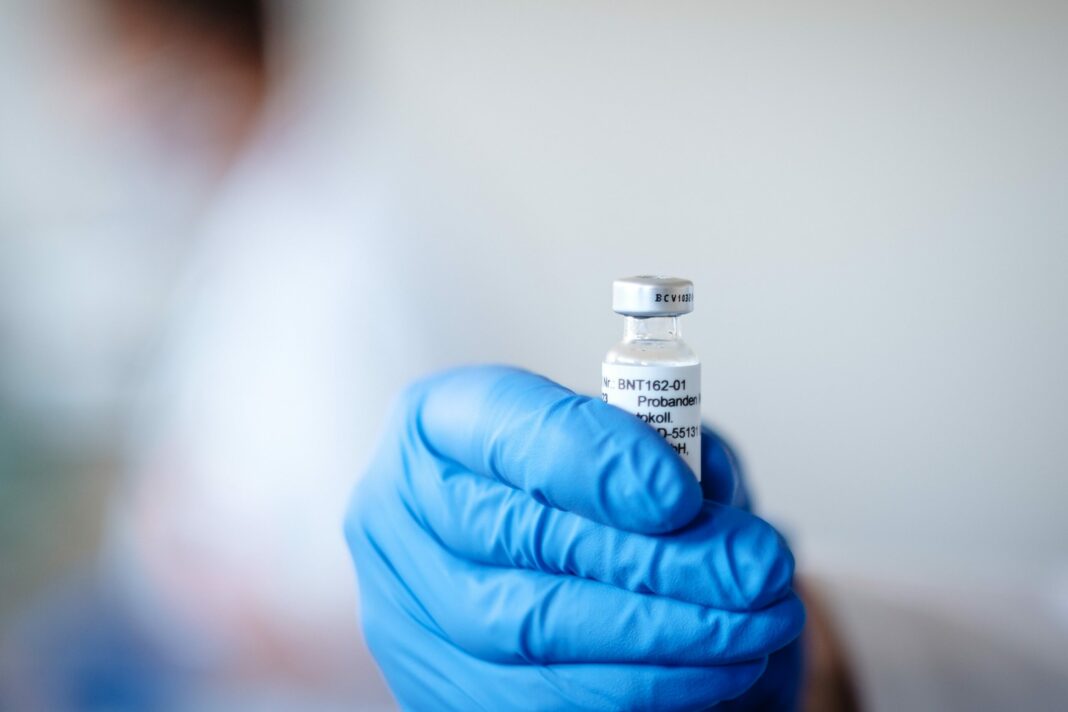
El Comité de Medicamentos Humanos (CHMP, por sus siglas en inglés) de la Agencia Europea del Medicamento (EMA, por sus siglas en inglés) ha otorgado la autorización condicional de comercialización a la vacuna de Pfizer y BioNTech contra el COVID-19 en personas de más de 16 años.
Así lo ha anunciado este lunes en rueda de prensa la directora ejecutiva de la EMA, Emer Cooke, tras la reunión del comité para evaluar la vacuna. «La evaluación científica de la EMA se basa en la fuerza de las pruebas científicas sobre la seguridad, calidad y eficacia de la vacuna, y nada más. Las pruebas demuestran de forma convincente que los beneficios son mayores que los riesgos de esta vacuna», ha señalado.
Tras la luz verde por parte de la agencia reguladora europea, la Comisión Europea espera concluir el proceso formal de aprobación este mismo lunes, a pesar de que se trata de una burocracia que habitualmente requiere 67 días, según ha anunciado la presidenta del Ejecutivo comunitario, Ursula von der Leyen, a través de Twitter.
«Es un momento decisivo en nuestros esfuerzos para dar vacunas seguras y efectivas a los europeos. La EMA acaba de publicar una opinión científica positiva de la vacuna de BioNTech y Pfizer. Ahora actuaremos rápido, espero una decisión de la Comisión para esta tarde», ha escrito la alemana. Así, si no se produce ningún contratiempo, los países europeos, entre ellos España, comenzarán a recibir las dosis el sábado 26, para iniciar las campañas de vacunación el domingo 27.
En la rueda de prensa, Cooke ha defendido que este dictamen científico de la EMA garantiza que la vacuna llegará a Europa «con las correspondientes salvaguardias, controles y obligaciones». «Nuestra evaluación exhaustiva significa que podemos asegurar con confianza a los ciudadanos de la UE la seguridad y eficacia de esta vacuna y que cumple las normas de calidad necesarias. Sin embargo, nuestro trabajo no se detiene aquí. Seguiremos recogiendo y analizando datos sobre la seguridad y la eficacia de esta vacuna para proteger a las personas que la toman en la UE», ha asegurado.
La presidenta del Comité de Seguridad de la EMA, Sabine Straus, ha defendido que «el perfil de seguridad de la vacuna de COVID-19 a partir de los datos evaluados es tranquilizador». «La UE tiene un excelente sistema de vigilancia de la seguridad, con análisis y detección de última generación, para asegurar que identificamos la información de seguridad nueva o cambiante», ha añadido.
La máxima responsable de la EMA ha «celebrado y reconocido» el trabajo «incansable» de «un gran número de expertos de todos los Estados miembros de Europa y mis colegas de la EMA que participan en la revisión de la vacuna». «Esto es el resultado de una movilización y un intercambio de información sin precedentes entre los científicos, la industria, los reguladores, los profesionales de la salud y los pacientes de todo el mundo», ha esgrimido.
Cooke también ha señalado que las autoridades europeas le deben «transparencia» a los ciudadanos «para que puedan decidir sobre la vacunación en base a los hechos». Por ello, ha informado de que la EMA publicará información sobre la evaluación, incluyendo todos los datos clínicos evaluados en la solicitud. «Esto permitirá un mayor escrutinio independiente de los científicos», ha detallado.
Cooke ha recordado, igualmente, que esta autorización de comercialización condicional contiene un plan con obligaciones legalmente vinculantes para las compañías Pfizer y BioNTech, que generarán datos adicionales sobre la vacuna y se presentarán a la EMA «después de la aprobación». «Se han movilizado recursos adicionales para supervisar y evaluar la nueva información de seguridad a medida que está disponible. Para todas las vacunas de COVID-19, se han reforzado las obligaciones de información de las empresas», ha añadido Straus.
AVALADA POR UN ENSAYO EN MÁS DE 43.000 PERSONAS
El presidente del CHMP, Harald Enzmann, ha resaltado que el principal ensayo clínico de esta vacuna, en el que participaron más de 43.000 personas, es «uno de los más grandes evaluados para una vacuna». La mitad recibió la vacuna y la otra mitad recibió una inyección falsa, es decir, placebo. Las personas no sabían si recibieron la vacuna o el placebo.
Se calculó la eficacia en más de 36.000 personas a partir de los 16 años de edad (incluidas las personas mayores de 75 años) que no tenían ningún signo de infección previa. El estudio mostró una reducción del 95 por ciento en el número de casos sintomáticos de COVID-19 en las personas que recibieron la vacuna (8 casos de 18.198 presentaron síntomas de COVID-19) en comparación con las personas que recibieron una inyección ficticia (162 casos de 18.325 presentaron síntomas de COVID-19).
El ensayo también demostró una eficacia de alrededor del 95 por ciento en los participantes con riesgo de padecer COVID-19 grave, incluidos aquellos con asma, enfermedad pulmonar crónica, diabetes, hipertensión arterial o un índice de masa corporal mayor a 30. La alta eficacia se mantuvo en todos los géneros, grupos raciales y étnicos.
La vacuna se administra en forma de dos inyecciones en el brazo, con un intervalo de al menos 21 días. Los efectos secundarios más comunes fueron generalmente leves o moderados y mejoraron a los pocos días de la vacunación. Incluyeron dolor e hinchazón en el lugar de la inyección, cansancio, dolor de cabeza, dolor muscular y articular, escalofríos y fiebre.